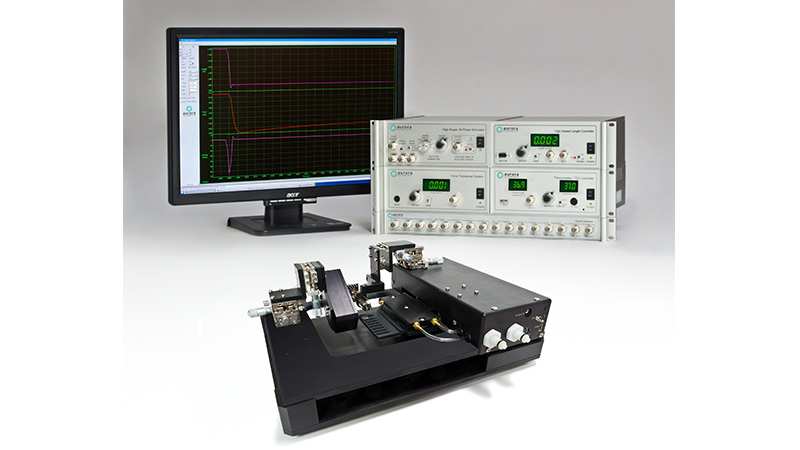
1600A:透性心肌细胞测量系统
一个高可靠度和高重覆度的测试系统:测量透性心肌细胞的被动性质和主动性质
1600A系统的设计理念建筑於针对去膜心肌细胞的收缩性能进行高可靠度的测量。除了让心肌细胞与传感器的连结过程能够在宽敞的空间下进行,配合按键式的电动化操作器可以更加轻易地把心肌细胞连结到我们的(400A系列)力传感器和(315C/322C)高速伺服电机。
1600A具有一个可控温的八孔浴槽平台,可以让心肌细胞在不同浓度的钙离子溶液之间进行连续性的过渡。该平台可以直接安置在倒置显微镜上,以进行成像观察和肌小节间隔的侦查。此外,可附加棱镜标线以测量细胞深度。
我们有来自世界各地不同的用户体验到1600A带来的方便和数据重现能力:力度、长度和肌小节间隔长度(需配置HVSL/VSL)都可以通过1600A去进行测量和控制。系统可以让您轻松地测量简单的方案—力度与钙浓度的关系,更可以测量心肌细胞一些比较复杂的力学性能:例如松弛实验(kTR),长度与张力的关系,力度与收缩速率的关系和硬度等。
1600A 是一个一站式系统,所以也具备数据采集和分析的配置。我们拥有完整的数据采集和数控系统(600A),配以标准方案库藏,使以上各种测量方案能够简单直接地进行操作。选择1600A,体验系统在您的研究进展中带来高性能和高精准的表现。
● 透性心肌细胞的完整测试系统
● 可控温的八孔浴槽平台
● 宽敞的细胞接合空间和电动化XYZ微定位平台
● 能够测量和控制力度、长度和肌小节间隔长度
● 测试平台可轻易安置於倒置显微镜上
● 测量力度与钙浓度的关系、松弛实验(kTR),长度与张力的关系,力度与收缩速率的关系和硬度等
● 可附加光学棱镜以测量细胞深度
八孔浴槽平台
使用可控温的八孔浴槽平台可以简便地测量心肌细胞的张力与钙浓度之间的关系。通过移动平台可以快速地把心肌细胞从一个浴槽转换至另一个浴槽。在八孔浴槽前方的盖玻片便是心肌细胞与传感器和电机的结合处。
整合肌小节长度
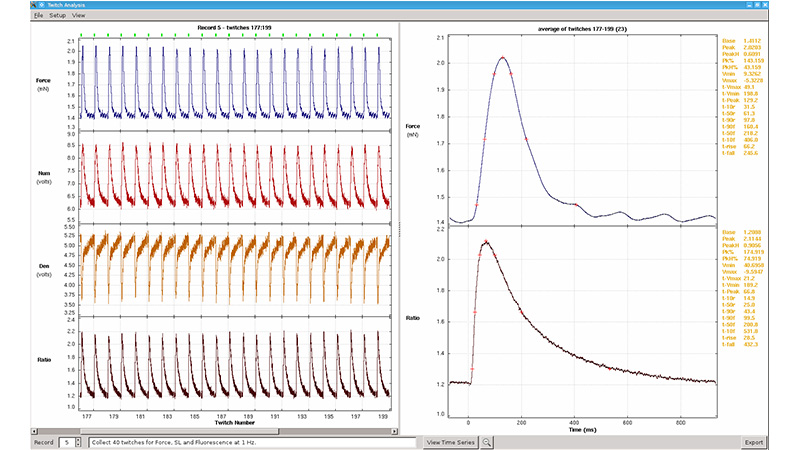
把900B/901B肌小节间隔长度检测软件附加到1600A,可以轻易且准确地测量和设定肌小节静息长度。在高帧率的摄像机可以和数据采集软件互相配合下,力、肌纤维长度,肌小节长度三个参数可以实时被纪录至一个时间点同步的文件。
就可以执行的实验类型而言,1600A系统与1400A非常相似。两个系统之间的巨大差异是它们打算使用的样本类型。1600A仅用于透化的心肌细胞。这些具有一些优点,因为可以培养肌细胞,确保充足的供应。通过创建活化溶液的小孔实现钙梯度,并在该系统中手动控制。尽管在技术上可行,但在该系统中使用较大的样品(例如骨骼纤维)并不常见,因为1400A的自动化是测试较大的去膜组织片的更具吸引力和更高通量的手段。
常见样品:
心肌:单个去膜心肌细胞
常见实验:
最大张力:当钙最大程度地激活时,肌细胞产生的张力。
力–pCa(骨骼或心脏):当用一系列钙浓度激活细胞以阐明钙敏感性时,肌细胞产生的最大张力。
kTR:张力重新发展的时间,其中细胞在钙中经历最大活化,然后快速缩短至零负载并恢复至原始细胞长度。
力-速度:钙中细胞的最大活化,然后是一系列力钳,达到最大力的百分比,从而可以测量缩短的速度。
长度-张力:逐步增加细胞长度或肌节长度以测量最大力的产生。
刚度:被动正弦延长和细胞缩短,以评估组织的固有刚度。
Frank-Starling机制(心脏):单细胞的长度依赖性活化及其对钙敏感性的影响。
Alegre-Cebollada, Jorge et al. “S-glutathionylation of cryptic cysteines enhances titin elasticity by blocking protein folding.” Cell (2014) DOI: 10.1016/j.cell.2014.01.056
Krysiak et al. “Protein phosphatase 5 regulates titin phosphorylation and function at a sarcomere-associated mechanosensor complex in cardiomyocytes” Nature communications (2018) DOI: 10.1038/s41467-017-02483-3
Gonçalves-Rodrigues et al. “In Vitro Assessment of Cardiac Function Using Skinned Cardiomyocytes” Journal of Visualized Experiments (2020) DOI: 10.3791/60427
Pappritz et al. “Impact of syndecan-2-selected mesenchymal stromal cells on the early onset of diabetic cardiomyopathy in diabetic db/db mice” Frontiers in Cardiovascular Medicine (2021) DOI: 10.3389/fcvm.2021.632728
Pappritz et al. “Impact of syndecan-2-selected mesenchymal stromal cells on the early onset of diabetic cardiomyopathy in diabetic db/db mice” Frontiers in Cardiovascular Medicine (2021) DOI: 10.3389/fcvm.2021.632728
Kötter, Sebastian et al. “Human myocytes are protected from titin aggregation-induced stiffening by small heat shock proteins.” The Journal of Cell Biology (2014) DOI: 10.1083/jcb.201306077
Horiguchi, Hiroshi et al. “Fabrication and evaluation of reconstructed cardiac tissue and its application to bio-actuated microdevices.” IEEE Transactions on NanoBioscience (2009) DOI: 10.1109/TNB.2009.2035282
Kolijn et al. “Enhanced Cardiomyocyte Function in Hypertensive Rats With Diastolic Dysfunction and Human Heart Failure Patients After Acute Treatment With Soluble Guanylyl Cyclase (sGC) Activator” Frontiers in Physiology (2020) DOI: 10.3389/fphys.2020.00345
Chung, Eunhee and Gary M. Diffee. “Effect of aging on power output properties in rat skinned cardiac myocytes.” The Journals of Gerontology Series A: Biological Sciences and Medical Sciences (2011) DOI: 10.1093/gerona/glr150
Waddingham et al. “Diastolic dysfunction is initiated by cardiomyocyte impairment ahead of endothelial dysfunction due to increased oxidative stress and inflammation in an experimental prediabetes model” Journal of Molecular and Cellular Cardiology (2019) DOI: 10.1016/j.yjmcc.2019.10.005
Hamdani, Nazha et al. “Deranged myofilament phosphorylation and function in experimental heart failure with preserved ejection fraction.” Cardiovascular Research (2013) DOI: 10.1093/cvr/cvs353
Rivas-Pardo et al. “A HaloTag-TEV genetic cassette for mechanical phenotyping of proteins from tissues” Nature communications (2020) DOI: 10.1038/s41467-020-15465-9